
百蓁生物DeepImmu新抗原发现平台通过建立高通量高灵敏度样品前处理及质谱检测技术流程,整合DeepNovo数据分析和免疫原性预测新算法可实现一周时间内“多.快.好.准”的新生抗原发现,为后续免疫治疗研发提供强有力支持。
多 :鉴定深度超越30000+免疫多肽,突破10mg组织样品极限(5000+多肽)
快 :一周实现从样本处理到新抗原预测报告
好:实验重现性好,免疫肽富集有效性高,谱图质量好,全流程质控
准:AI赋能的新抗原免疫原性预测,驱动高效的验证平台,筛选新抗原更准确。
利用 T 细胞靶向和杀死特定的癌细胞类型(即免疫疗法)已成为新型癌症疗法的前沿, CAR-T 疗法已在多种适应症中显示出显著的疗效,但在靶向实体瘤、功能持久性、肿瘤逃逸和避免复发方面仍需改进。越来越多的研究强调了新抗原与T 细胞识别癌细胞之间的关系。针对新抗原开发的疫苗现在正用于各种实体瘤的临床试验。
新抗原(Neoantigen)是一类由肿瘤细胞突变而产生的肿瘤特异性抗原。它主要在肿瘤细胞中表达新抗原,也可以通过病毒感染、可变剪接和基因重排产生。它们是T 细胞识别癌细胞的理想靶标,可以激发强烈的抗肿瘤免疫反应。

图 | 肿瘤新抗原与 T 细胞
新抗原对个体患者的肿瘤具有高度特异性,基于触发针对新抗原的T细胞反应的个性化疫苗加速了肿瘤患者个体化免疫治疗的发展。新抗原的鉴定、筛选是基于新抗原的免疫疗法的关键环节之一。

标准化样品制备和高效的免疫多肽提取前处理流程使实验具有较高的重复性,可在技术重复中获得较低的CV,国际最先进的高分辨率和高灵敏度质谱仪,以及专业的团队,是高质量实验结果的保证。

AI驱动DeepNovo Peptidome workflow大幅扩展了参考HLA配体图谱,同时分别将HLA-I和HLA-II 肽的数量增加了200%和46%。

DeepSelf:基于T细胞中枢免疫耐受机制的个性化免疫原性预测模型。
通过计算DeepSelf预测算法在每个患者中的ROC曲线下面积,来说明本预测算法的准确度,数值越高,说明结果越准确。

样本类型 | 细胞 | 组织 | 血液 |
样本最低需求量 | 107 | 50mg | 5ml |
样本制备要求 |
细胞样品需保持90%以上的活细胞率,同时防止支原体污染。 |
新鲜制备是为最佳;液氮速冻保存。注:防止血液污染 |
新鲜制备是为最佳;液氮速冻保存。注:防止出现溶血现象 |
样本运输要求 | 使用足量干冰运输,期间避免冻融,尽量选用顺丰快递,防止样品降解。 | ||
交付标准 (报告内容) | 1. 鉴定到的免疫肽列表 2. 质控结果 3. 所有新生抗原及其对应的蛋白信息列表 4. 所有新生抗原对应蛋白功能富集分析 5. DeepImmu预测免疫原性排名前十新生抗原列表 6. 完整的实验报告 | ||

2016 年来自德国马普的科研人员MichalBassani-Sternberg 等在题为“Direct identification of clinically relevant neoepitopes presented on native human melanoma tissue by masss pectrometry”文章中,利用基于质谱的免疫肽组分析和外显子测序技术研究黑色瘤中的肿瘤新生抗原,最终发现了 11 条发生突变的免疫肽,并经过Elispot 实验验证,发现其中 4 条具有免疫源性。文中分析使用的平台为maxquant,是以外显子测序数据作为database 进行搜索,进而发现突变的免疫肽。
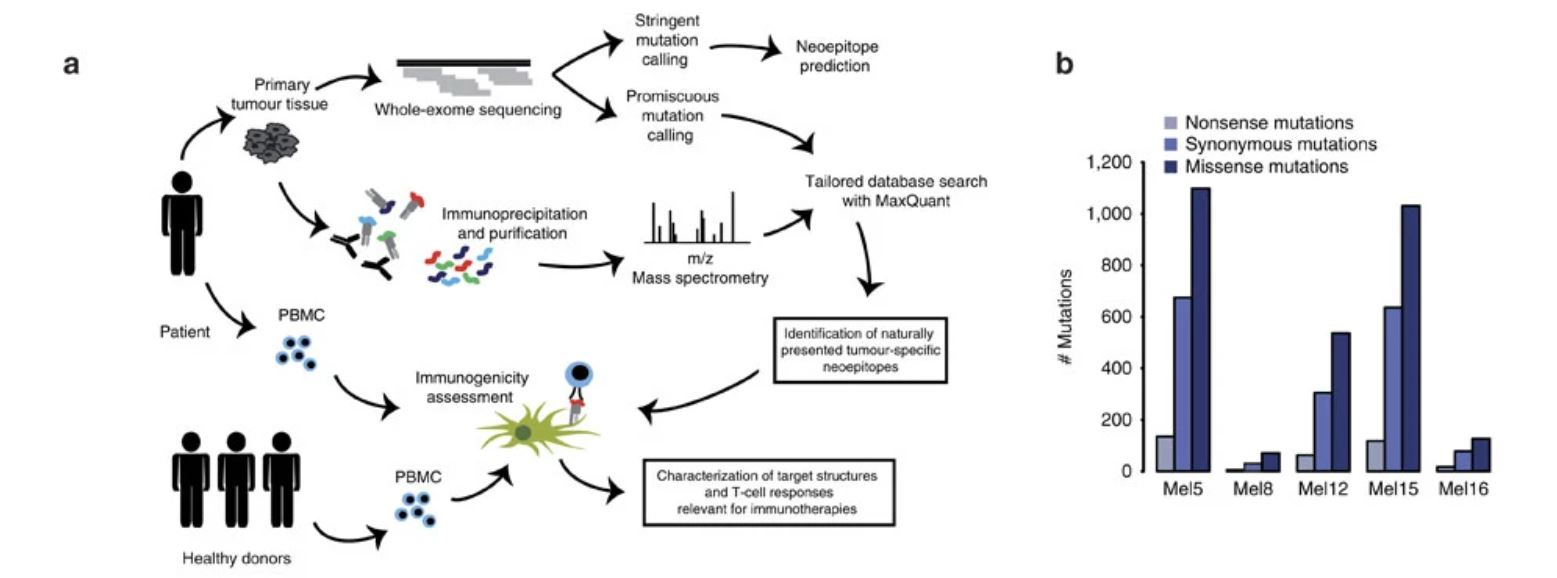
我们使用DeepImmu 平台对文献中的数据进行de novo 从头测序分析,不依赖于外显子测序构建database。其中多数突变的免疫肽均被鉴定到(见表 1)。并且我们还额外鉴定到一条突变的免疫肽是文章中没有报道出来的。
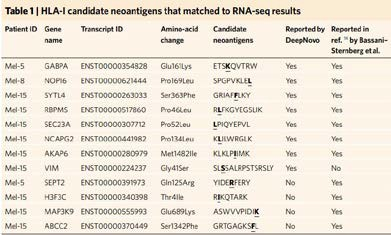
表 1 | 使用 DeepImmu 分析结果与文献中分析结果对比
接下来我们是用DeepImmu 对文章报道的的突变的免疫肽段进行免疫原性预测,并且与另外的免疫原性预测软件
IEDB 进行对比,根据预测的免疫原性强弱对其进行排名,结果表明使用DeepImmu预测的结果与文中使用Elispot的实验结果高度吻合,明显高于IEDB 预测的结果准确性,见表 2. 并且我们没有检测到的几条免疫肽,在Elispot 免疫源性试验中也是没有免疫源性的。这就进一步表明DeepImmu 平台的准确性。
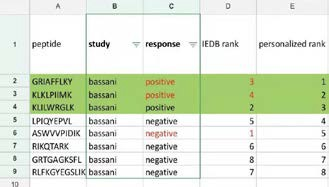
表 2 | 不同软件免疫原性预测结果比较
Response:文章中使用 Elispot 验证免疫原性结果;IEDB rank:使用 IEDB 预测免疫源性强弱排名;personalized rank:使用DeepImmu 预测免疫源性强弱排名