来源:百小蓁发布时间:2023-12-22浏览量:102次
抗体表位定位对于了解适应性免疫、学习治疗性抗体和疫苗的作用模式直观重要。尤其是对疫苗接种而产生的多克隆抗体群体(pAb)的结合性质的深入了解,有助于为疫苗开发提供独特的价值。然而,大多数表位定位方法不能对复杂的抗体样品进行较好的分析。因此,2021年7月,来自葛兰素史克公司的Nathalie Norais团队和来自哥本哈根大学药学院的Kasper Rand团队在《Analytical Chemistry》上发表了题为“Epitope Mapping of Polyclonal Antibodies by Hydrogen−Deuterium Exchange Mass Spectrometry (HDX-MS)”的文章。旨在介绍一种通过氢氘交换质谱(HDX-MS)快速高效定位多克隆抗体表位的工作流程。

抗原-抗体相互作用在免疫学中起着关键性作用,表位定位的方法有多种,其准确性和识别表位构象的能力也不尽相同。HDX-MS具有快速、样品需求量少、对样品要求低等优点,是表位定位的重要分析手段。HDX-MS是利用质谱检测蛋白骨架肽键上的氢氘交换情况,比较未结合蛋白与结合蛋白的氘掺入量变化情况鉴定目标蛋白的结合位点。本文通过HDX-MS手段表征兔多抗(抗体)与免疫H因子结合蛋白(fHbp,抗原)的表位,证实了HDX-MS定位蛋白表位的优越性。
实验方法:
首先,在不氘代的情况下,采用CID模式下的DDA/DIA的质谱方法分别对结合和未结合兔多抗的fHbp进行肽段鉴定;
然后,从抗原和抗体比例、氘代时间、变性剂等方面进行HDX-MS实验定位fHbp表位;
最后,通过溶剂可极性分析(VADAR 1.8)和多肽二级结构预测(PEP2D)对结构进行补充佐证确认主要表位区域。
实验设计:
Step 1:抗原:抗体1:2,分别氘代30s、5min、10min、20min,找出最佳氘代时间点;
Step 2:采用step1 确定的最佳氘代时间点,考察抗原:抗体1:2、1:5、1:10、1:15的氢氘交换情况,评估多抗群体的相对亲和力;
Step 3:采用step1和step2确定的条件,比较在氘代试剂中不添加和分别添加0.5M NaCl/尿素/硫氰化铵(AT)、2M尿素/AT、4M尿素/AT等的HDX-MS结果,评估结合特异性和限制非特异性相互作用;
Step 4:采用step2确定的抗原、抗体比例,比较在氘代试剂中不添加和分别添加0.5M NaCl/尿素的HDX-MS结果,评估变性试剂对肽键氢氘交换速率的影响。
结果与讨论:
fHbp是一个27KD的结构表征成熟的脂蛋白,其N端由2条反向平行的塔可形状的β链和linker连接组成,C端由8条β链连接形成桶装结构,如下图2所示。
Step 1:
当抗原:抗体1:2时,fHbp蛋白覆盖率达99.2%,HDX-MS实验检测到fHbp N端3-26、44-72、104-120以及C端137-166、209-234五个区域氘掺入量有明显减少,该结构区域可能是由于与抗体结合而无法进行氢氘交换;通过比较4个不同氘代标记时间带点,确定10min为最佳标记时间。
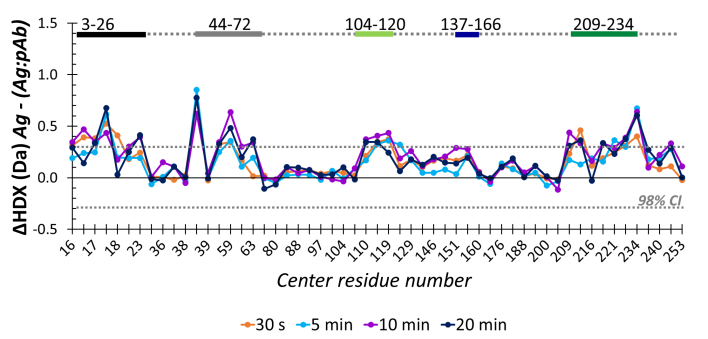 图1 抗原:抗体1:2时fHbp不同标记时间点氘掺入量差异图
图1 抗原:抗体1:2时fHbp不同标记时间点氘掺入量差异图
Step 2:
确定标记时间设置为10min后,将抗原:抗体比例逐渐增加1:2、1:5、1:10、1:15,step1 所述的N端3个区域随着抗体量增加,氘掺入量随之减少。所有鉴定肽段的平均ΔHDX(特定条件下氘掺入量与全氘代的差值)差异由3%(1:2)增加至16%(1:15),N端3-26的ΔHDX差异由2%(1:2)增加至12%(1:15),N端44-72的ΔHDX差异由1%(1:2)增加至11%(1:15);研究表明,这种变化可能是由于当抗体浓度低时,单个抗体与抗原比例低于1:1造成的,因此检测到的结构可能反应的是抗体结合对的相对滴度,而非亲和力。而C端2个区域的平均ΔHDX变化则不太显著,仅在抗原:抗体超过1:10时才检测到ΔHDX的显著变化。
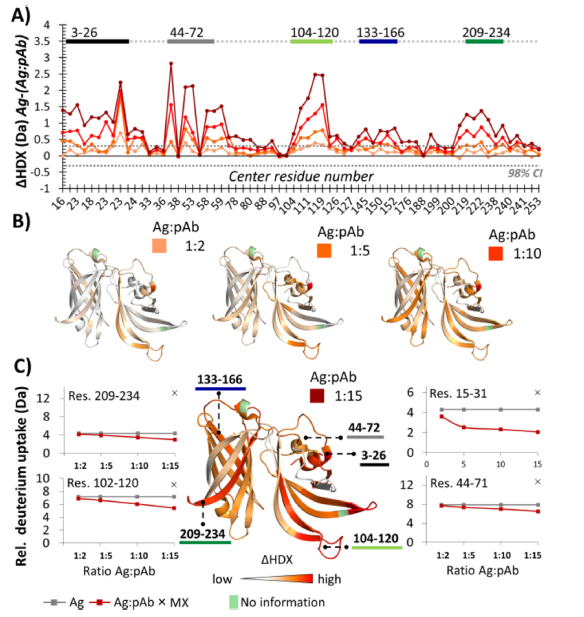
图2 fHbp在不同抗原抗体比例的HDX-MS结果
作者通过X射线晶体学研究和VADAR 1.8软件进一步确认HDX-MS定位的表位区域。结合VADAR和HDX数据,确认N端3-26和44-72构成一个表位区域,104-120则在N端的另一端形成表位,C端137-166和209-234则在β桶状结构的对面形成2个表位区域。值得注意的是,经VADAR分析,并非所有暴露的氨基酸位点都参与形成表位,如图3所标注的玫红色位点。
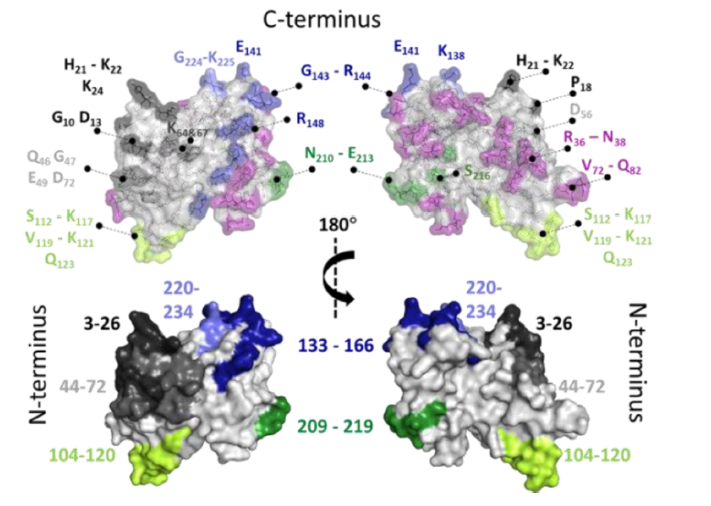
图3 结合VADAR和HDX数据的fHbp表位区域
Step 3:
抗体亲和度、抗原抗体效价和相互作用共同决定了抗体的特异性,从而决定了抗体与特定抗原表位结合的可能性。在进行多抗分析时,低亲和度IgGs可以在尿素、硫氰酸铵(AT)或GndHCl等蛋白质变性剂存在的情况下从抗原上解离。作者采用类似的策略进行HDX-MS试验,以测试抗原抗体结合的特异性,并最终限制非特异性相互作用。即当抗原抗体1:10时,分别测试不同种类和浓度的盐和变性剂的ΔHDX,测试结果显示,0.5M AT存在的情况下,N端3-26、44-71及C端176-184区域ΔHDX明显增加;类似的和2M尿素存在情况下,N端3-26、44-71区域ΔHDX明显增加;而0.5M尿素和0.5M NaCl存在时,并非明显改变ΔHDX,即fHbp的构象保持在原生状态。
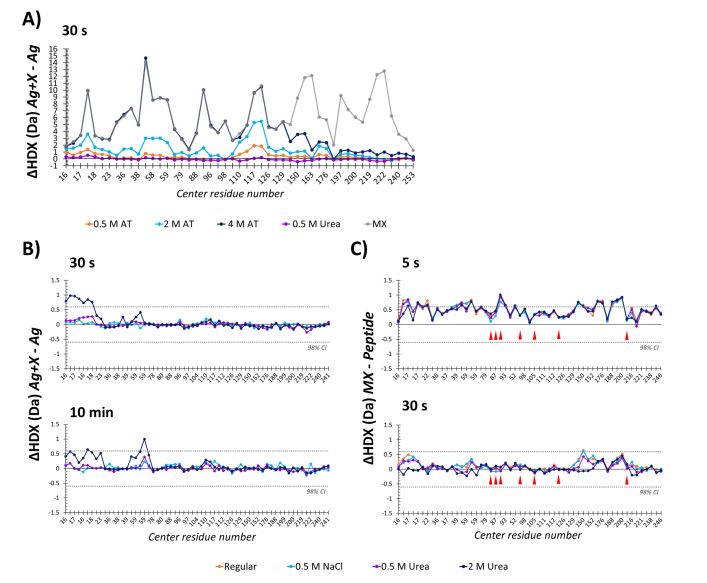
图4 不同变性添加剂对fHbp构象和化学交换率的影响
Step 4:
为测试离子强度对氢氘交换速率的影响,作者通过分别添加0.5M尿素和0.5M NaCl测试fHbp的HDX变化,并结合PEP2D分析表明,0.5M尿素或0.5M NaCl不会改变fHbp的固有构象,不存在非特异结合。但NaCl的存在会破坏N端3-26、104-120区域的静电相互作用,尿素的存在会破坏C端133-166、209-234区域的氢键作用力。
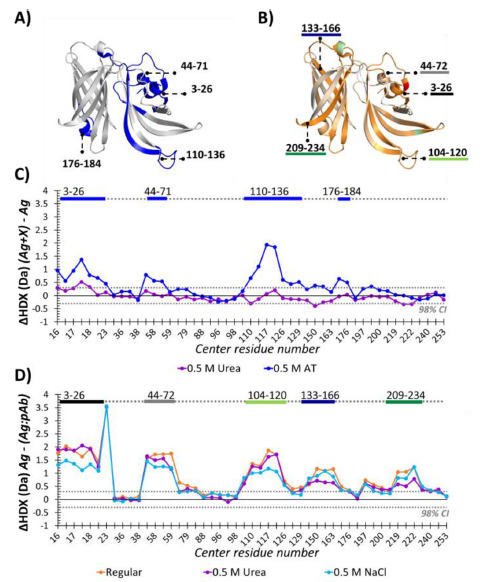
图5 添加剂对抗原结构及抗原抗体结合的影响
结论:
本文作者建立了通过HDX-MS绘制疫苗接种后产生的复杂多抗混合物所识别的目标抗原表位的工作流程,并对氘代标记时间、抗原抗体比例、盐及变性剂种类和浓度进行了优化研究。通过VADAR和PEP2D表明,该工作流程能够鉴定到来自不同动物的多克隆抗体样本识别的fHbp上有限的、明确数量的免疫显性表位,部分表位与先前报道的鼠或人单克隆抗体所识别的表位一致。该流程可以直接用于多抗样本,无需进行抗体分离富集,大大提升检测效率,广泛适用于其他抗原和抗体样本的表位定位,以及人疫苗接种的免疫反应监测。总之,HDX-MS方法可为免疫学、结构血清学和疫苗设计等提供很大的实用价值。
百蓁实验平台的优势: HDX-MS 方法的优势: 数据分析与结果呈现的优势:
a. 低温精控全自动化样品前处理系统,低回交率,高重现性,高定量准确性;实现秒到小时时间尺度的蛋白质高级结构精确表征;
b. 搭载Thermo Orbitrap超高分辨三合一质谱仪,Top-Down、Middle-Down、Bottom-Up三种分析模式,CID、HCD、ETD多种碎裂方式,提升质谱采集数据广度与覆盖度;
c. 自主PEAKS软件平台深度解析质谱数据,获取更高深度和准确度肽段信息;
a. 蛋白质在溶液中处于天然状态而非晶体状态,直接鉴定蛋白复合体构象;
b. 能够进行蛋白质结构动态变化的研究,包括变化中的活性位点及表位;
c. 质谱检测灵敏度高,蛋白质样品用量少(微克级);对样品纯度要求低;质谱分析速度快,极大缩短实验周期。
a. HDExaminer定量分析结合人工校准,精确分析氘掺入量变化趋势,可完成抗体表位分析、抗体批次间差异效应分析、蛋白质相互作用分析、蛋白质-配体相互作用分析、蛋白质动态结构变化分析等多种需求。
b. 多种可视化结果呈现方式,并可以通过pyMOL或Chimera渲染到蛋白质晶体结构,简洁形象。