来源:百小蓁发布时间:2024-01-12浏览量:581次
N-糖基化是指寡糖部分共价结合在分泌糖蛋白或膜糖蛋白上的天冬酰胺(Asn)侧链上。在人类基因组中编码的蛋白质中,大约有50%的蛋白质具有糖基化序列。由于翻译后修饰在确定生物制剂的有效性、安全性和药代动力学特性方面的重要性,N-糖基化是免疫球蛋白G (IgG)和IgG类似药物的关键质量属性。
IgG抗体具有两个相同的N-糖基化位点,分别位于两条重链的Fc区。其他蛋白质,如双特异性单抗或FC融合蛋白,可能有额外的糖基化位点。IgG在Fc区一个或两个重链CH2区域的Asn297处糖基化(图1a),对单克隆抗体以及双特异性、抗体-药物偶联物和FC-融合蛋白的研究发现聚糖可影响抗炎反应和效应功能活性,包括抗体依赖性细胞毒性(ADCC)和互补依赖性细胞毒性(CDC),此外,甘露糖、半乳糖或唾液酸等聚糖部分可显著影响单抗和含FC治疗蛋白的免疫原性和/或药代动力学。
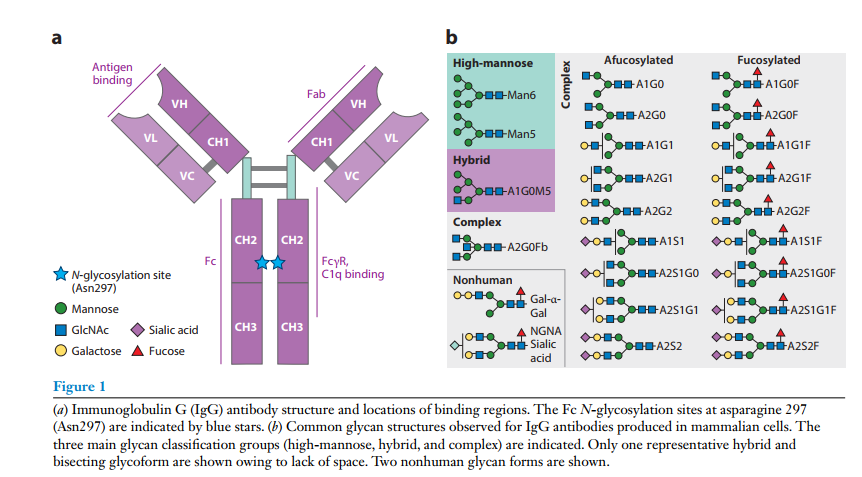
一、N糖基化对蛋白的影响
1. Fc片段糖基化调节效应功能活性
IgG的FC-糖聚可以显著改变治疗活性。IgG可通过Fab (antigen-binding fragment) 区与靶抗原结合,当靶标参与细胞表面表达,IgG Fc可以介导与FcγR在效应细胞上表达,包括自然杀伤细胞(NK)、单核细胞、巨噬细胞和中性粒细胞,并诱导ADCC和抗体依赖细胞介导的吞噬作用(ADCP)。其次,Fc区也可以结合到血清补体(C1q)上,导致经典补体途径的激活,最终形成膜攻击复合体,导致细胞裂解。
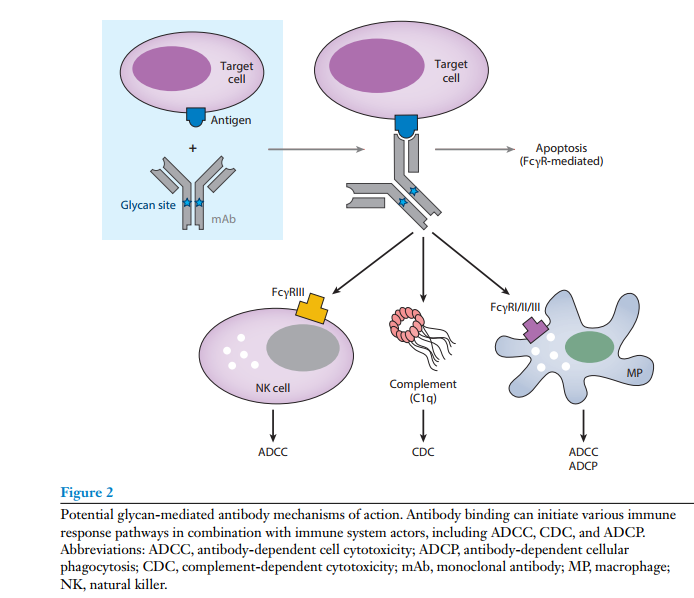
2. N-糖基化影响免疫原性
影响免疫原性有许多因素,包括蛋白质序列变异、糖基化、去神经化和聚集等。在小鼠髓系细胞中产生的治疗性单克隆抗体,如表皮生长因子受体(EGFR)单抗,在FC-聚糖上含有半乳糖寡糖-α-1,3-半乳糖(α-gal),α-Gal在异种移植中作为主要抗原屏障,大量α半乳糖具有极高的免疫原性风险。由于α-1,3-半乳糖转移酶基因的缺失,人类和其他灵长类动物缺乏合成具有α-半乳糖糖蛋白所必需的生物合成机制。通过中国仓鼠卵巢细胞CHO表达系统制备EGFR单抗,Fab区域聚糖结构中不含有α-Gal,免疫原性风险极大降低,由此表明同一抗体在不同的表达体系下由于糖基化的影响其免疫原性也不同。
3. N-糖基化影响药代动力学
人类新生儿受体(FcRn)对于向胎儿转移体液免疫至关重要。在含FC药物的情况下,FcRn控制分子的分解半衰期。酸性核内体中的FcRn通过胞吞作用与IgG结合,然后IgG被循环到细胞表面,并在血液的pH值释放出来。此外,FcRn在保护IgG免受降解方面也有重要作用。在血管内皮细胞中,FcRn介导的IgG内化和循环是维持IgG水平的重要机制,FcRn是主要组织相容性复合体I类家族的成员,由α-链和三个与I类分子共同亚基β2-微球蛋白非共价相关的细胞外结构域组成。IgG-Fc与FcRn的相互作用被认为是独立于Fc糖基化的,与特定聚糖结合和清除蛋白质的其他受体包括与N-聚糖末端半乳糖残基结合的去乙酰糖蛋白受体和识别末端甘露糖或GlcNAc的甘露糖受体。
二、聚糖表征的分析方法
对于大多数抗体,Fc区存在一个N链糖基化位点;然而,对于许多其他蛋白质,可能存在多个N-和O-糖基化位点。在这些情况下,对特定位点的糖聚糖进行检测是至关重要的。糖基化分析可分为三类:(a)完整的糖蛋白分析,(b)糖肽分析,(c)使用化学或酶解方法释放的糖分析。其中,前两种方法保留了聚糖的位点特异性。
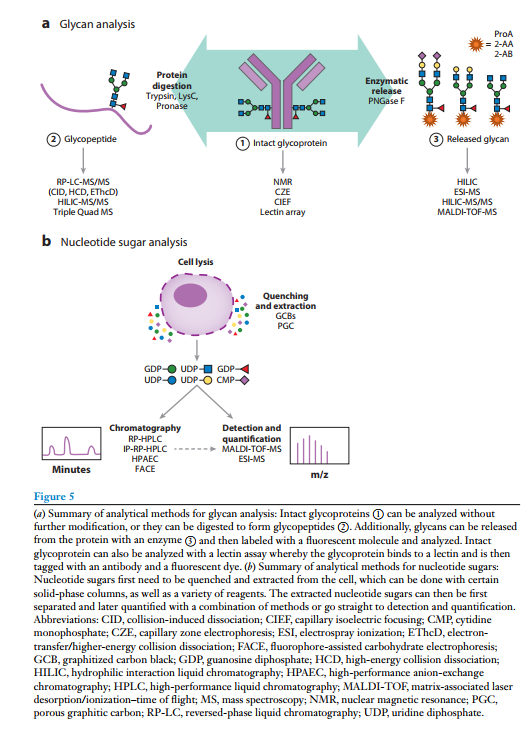
1.完整糖蛋白分析
抗体的大尺寸以及完整糖蛋白的溶解性和对固定相的吸附问题经常使在质谱分析中对完整糖蛋白分析更复杂。然而,在一项质谱补充方案中,Schubert等人提出了一种利用核磁共振(NMR)光谱分析完整糖蛋白的方法,核磁共振波谱可以确定聚糖的立体化学和连锁类型,但不能确定聚糖的位置。此外,完整的糖蛋白也可以用凝集素阵列、毛细管区带电泳和毛细管等电聚焦来分析。
2. 糖谱分析
糖谱分析是用特异性的酶进行糖分子的切割,利用荧光分子进行检测和增加质谱信号,然后检测所有糖分子。这种标记最常用的是还原性胺化及过氧化甲基化,N-糖谱通常使用一种酶(如PNGase F)从蛋白质中释放聚糖,然后通过还原性胺化标记,标记的聚糖通常在亲水性相互作用液相色谱柱上分离,随后用荧光计检测。此外,分离后的聚糖也可以使用电喷雾电离质谱(ESI-MS)或基质辅助激光解吸/电离时间飞行质谱(MALDI-TOF-MS)在运行和检测。
3. 糖肽分析
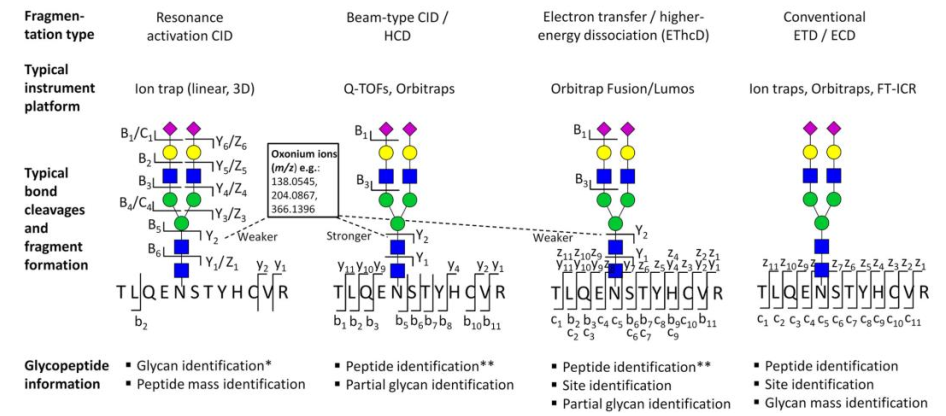
糖肽类的分析不仅可分析聚糖类型还可以对糖苷进行位点特异性分析。蛋白质被蛋白酶(如胰蛋白酶、LysC) 酶切以生成更短的肽以便于分析。糖肽类的电离效率低于多肽,因此通常需要富集,富集可通过凝集素、亲水性相互作用固相萃取、色谱或石墨化碳固相萃取进行。串联质谱可以用各种电离模式来全面表征糖肽,包括碰撞诱导解离(CID)、高能碰撞解离(HCD),以及EThcD。CID倾向于裂解糖苷键,但不能提供糖基化位点和氨基酸序列的充分信息。HCD提供诊断氧离子和部分糖肽信息。EThcD是一种两步破碎策略,获得多种离子类型,并允许更彻底的糖肽表征。目前对糖肽质谱数据的解析的工具也在不断发展,例如pGlyco3以及PEAKS GlycanFinder等。
案例:百蓁生物采用PEAKS GlycanFinder检测HEK293和CHO细胞中CD33表达的聚糖谱差异
对来自CHO表达的CD33(R&D)和HEK293表达的CD33(SinoBiological)进行胰蛋白酶消化,使用nanoElute®UHPLC分离多肽,然后在timsTOF Pro (Bruker)仪器上进行分析。使用PEAKS GlycanFinder模块分析所有原始数据。母离子、聚糖和二级碎片离子质量误差分别设置为15 PPM、20 PPM和0.05 Da,氧化(M)和脱酰胺化(NQ)设置为可变PTM,FDR设置为1%。
在CD33上鉴定了6个N-链糖基化位点(图1)。此外,在N-链位点附近检测到广泛的O-链糖基化,显示鉴定含有N-和O-链聚糖的糖肽的重要性。

图1. CD33的肽/糖肽图谱。蓝色条表示非糖肽,而紫色和橙色分别表示N-连接和N+O-连接的糖肽。每个肽上的彩色方块代表不同的聚糖和修饰;氨基甲基化用红色表示。
GlycanFinder软件进一步提供了饼状图(图2A),显示了糖蛋白中任意选定的糖基化位点上不同聚糖的相对丰度。使用该工具,可以观察到HEK293和CHO细胞表达CD33中N99位点聚糖的丰度存在显著差异。在CD33的所有糖基化位点中,有380种独特的N-链聚糖被鉴定出来,其中只有约40%被HEK293和CHO样品共享(图2B)。这表明,在不同的宿主细胞系统中表达糖蛋白时,糖谱会发生巨大的差异。
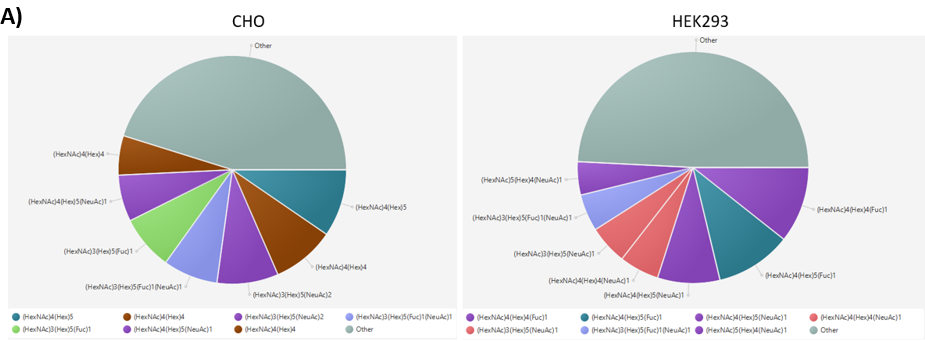
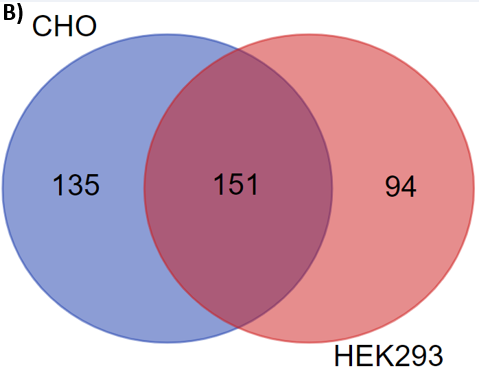
图2.CD33中N99位置的聚糖位点分析(A)和维恩图(B)
糖肽谱通常非常复杂,许多MS/MS扫描在糖蛋白组学数据中无法识别。部分原因是公开可用的glycan数据库不完整。为了帮助解决这个问题,glycanfinder进行了glycan de novo,可以利用深度学习算法发现在糖库中不包含的聚糖。在发现新的聚糖后,我们的聚糖数据库查看器中的聚糖编辑器提供了一种用户友好的方式,可以将聚糖添加到现有的聚糖数据库中。
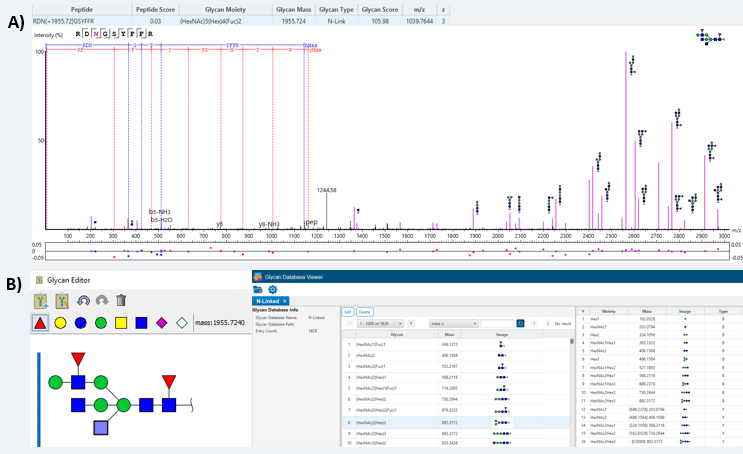
图3. 识别在聚糖数据库中找不到的聚糖,并使用聚糖数据库查看器将其添加进去。A)通过从头测序鉴定的糖肽谱。肽b-和y-离子分别以蓝色和红色突出显示,带注释的聚糖片段离子以紫色显示。B)聚糖编辑器(左)允许用户添加创建聚糖并将它们添加到现有数据库(右)。
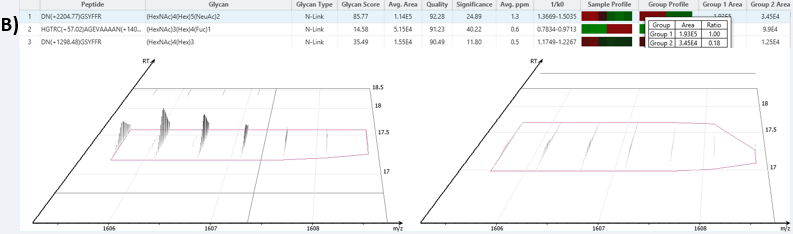
聚糖位点分析工具显示,两个CD33样本共享的某些聚糖丰度保持相对相似(图4A,如(HexNAc)2(Hex)4糖),而其他共享的糖在HEK293和CHO样品之间存在显著差异。在PEAKS GlycanFinder中使用糖肽峰面积值准确地比较不同样品组间聚糖的丰度(图4B),以提供每个样本和组别中糖肽水平的变化。
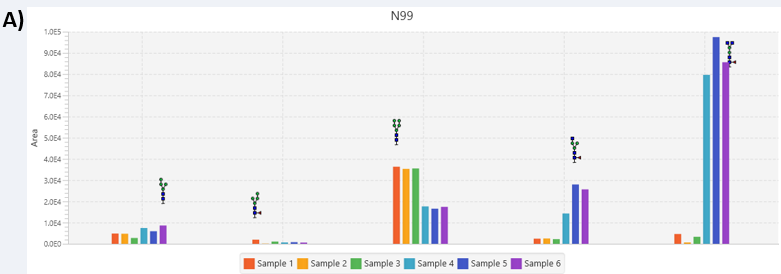
参考文献
1. Natalia I. MajewskaMax L. TejadaMichael J. BetenbaughNitin Agarwal.N-Glycosylation of IgG and IgG-Like Recombinant Therapeutic Proteins: Why Is It Important and How Can We Control It?[J].Annual review of chemical and biomolecular engineering, 2020, 11(1).
2. St. Amand MM, Hayes J, Radhakrishnan D, Fernandez J, Meyer B, et al. 2016. Identifying a robust design space for glycosylation during monoclonal antibody production. Biotechnol. Prog. 32:1149–62.
3. Villacrés C, Tayi VS, Lattová E, Perreault H, Butler M. 2015. Low glucose depletes glycan precursors, reduces site occupancy and galactosylation of a monoclonal antibody in CHO cell culture. Biotechnol. J.10:1051–66.
4.Lammerts van Bueren JJ, Rispens T, Verploegen S, van der Palen-Merkus T, Stapel S, et al. 2011. Antigalactose-α-1,3-galactose IgE from allergic patients does not bind α-galactosylated glycans on intact therapeutic antibody Fc domains. Nat. Biotechnol. 29:574–76.
5. Schubert M, Walczak MJ, Aebi M, Wider G. 2015. Posttranslational modifications of intact proteins detected by NMR spectroscopy: application to glycosylation. Angew. Chem. Int. Ed. 54:7096–100