来源:百小蓁发布时间:2023-11-23浏览量:118次
新抗原(Neoantigen)是一类由肿瘤细胞突变产生的肿瘤特异性抗原,是T细胞识别癌细胞的理想靶点,可激发强烈的抗肿瘤免疫反应。新抗原的鉴定和筛选是以新抗原为基础的免疫治疗的关键步骤之一。针对大家对“肿瘤新生抗原发现”服务送样的样品要求和细节的一些疑问和困惑,小编汇总整理了以下常见问题供大家参考。
主要组织相容性复合体(MHC)与抗原肽形成肽-MHC复合物起呈递抗原的作用,供T细胞识别产生免疫应答,Fig 1所示。MHC I型呈递内源性抗原(大多由8-12个氨基酸组成),肽-MHC被传递到细胞表面,可以激活特异性的杀手CD8+ T细胞对肿瘤细胞进行扑杀;MHC II型呈递外源性抗原(大多由13-25个氨基酸组成),肽-MHC被传递到细胞表面,激活特异性辅助T细胞(CD4+ T细胞),并由此启动下游的免疫反应。
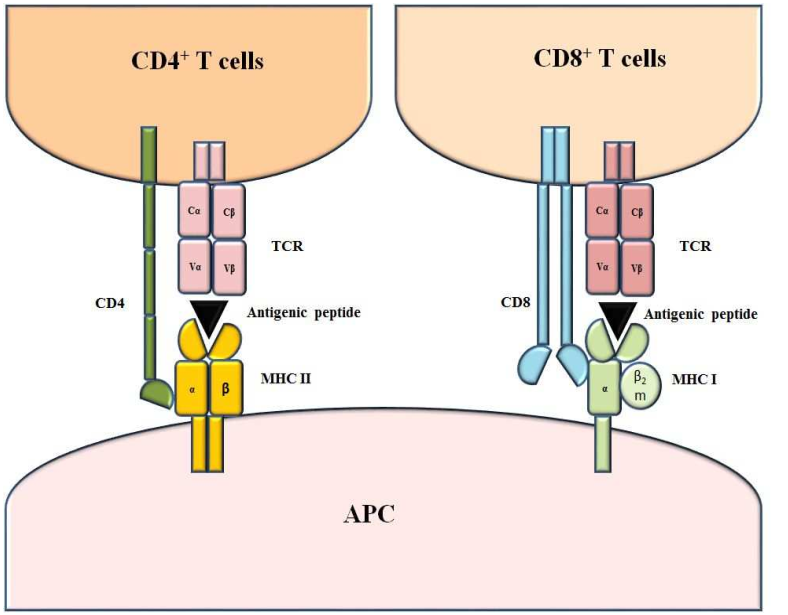
Fig1. MHC I和MHC II复合物模型与作用模式
NGS测序通过转录组或外显子组序列等分析进行变异鉴定,然后再使用MHC 亲和力预测算法来进行具有良好免疫原性靶标的筛选,这种方法缺点是会产生大量的候选突变多肽,导致许多假阳性结果。另外由于NGS是基于蛋白编码区,主要关注的是非同义核苷酸突变(SNVs)等典型肿瘤新生抗原,而不能充分评估其它非典型肿瘤新生抗原(如 RNA翻译异常、翻译后修饰、蛋白酶体剪接导致的新生抗原)。
相比之下,质谱法鉴定肿瘤新生抗原的优势有:
1.基于质谱的肽段鉴定方法可以更直接、准确地鉴定到新生抗原;
2.可以特异性的富集MHC I型或MHC II型的免疫肽,检测到的免疫肽特异性更高;
3.质谱数据结合de novo从头解析的技术,不依赖于已有数据库,可以发现更多的非典型新生抗原;
4.特有的免疫原性预测算法DeepSelf对非典型新生抗原的筛选有更好的效果。
5.可以分析免疫肽的翻译后修饰信息,覆盖到更多的新抗原。
我们是可以鉴定人源或鼠源的MHC I型或MHC II型的免疫肽或新生抗原。MHC I型或MHC II型在样本的前处理所用的抗体有所不同,在组织或细胞上都有成功的项目经验。
人源或鼠源的组织和细胞系MHC I/MHC II都是可以检测的,组织样本标准的需求量是50mg,细胞样本标准的需求量是1*107个。对于微量样品,如肿瘤组织穿刺样本(~10mg)或极低量的细胞样本(106个),也是可以进行免疫肽或新抗原检测的。
生物学重复对于研究特定人群中某一疾病共有的新生抗原有意义,需要进行多样品的实验分析。
百蓁生物在DeepImmu平台中运用了特殊的人工智能算法,是否有对照样本对于新抗原的发现和筛选不是必须的,对照样品有一定帮助。
针对人源或鼠源样本的HLA-I或HLA-II型的免疫肽都是可以执行的,满足送样要求,细胞样本可以鉴定到10000+免疫肽,组织样本可以鉴定到5000+免疫肽,有的样本可以鉴定到30000+免疫肽,和文献报道的数量相比,我们流程鉴定到的数量有大幅度提高,处于遥遥领先的水平。
“肿瘤新生抗原发现”服务的交付内容有:
1. 实验方法;
2. MHC WB质控结果;
3. 鉴定的免疫肽段及其对应的蛋白信息列表;
4. 免疫肽的MHC结合基序分型分析;
5. DeepSelf预测免疫原性排名的新生抗原列表。
符合送样要求,从开始检测到报告发送标准周期是2周完成交付,加急的话,最快1周也是可以完成的。
肽段的免疫原性依赖于3个因素:MHC、Neoantigens、TCR。免疫肽组领域预测新抗原特异性T细胞识别最常用的算法有PRIME,NetMHCpan,IEDB等,它们通过预测MHC结合,C端切割亲和力和TAP转运来生成复合评分,而不是直接预测免疫肽与T细胞的结合。
我们在DeepImmu平台中通过自有的DeepSelf算法进行免疫原性的预测,本算法基于模拟免疫中心耐受系统建立了TCR、免疫肽和MHC相互作用模型,准确率相对于其他方法有大幅度提高,如下图所示。
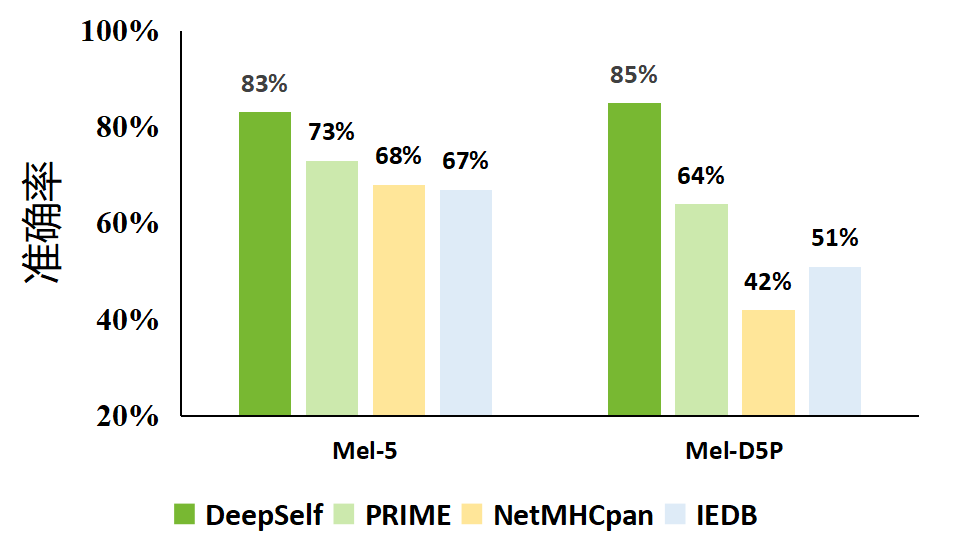
Fig2.不同平台免疫原性预测准确性比较
我们有细胞水平如酶联免疫吸附斑点(ELISPOT)验证平台,可以根据客户需求对候选新抗原进行免疫原性评估,可提供从新抗原鉴定到最终验证一体化的分析检测服务。如有动物模型验证需求,可与我们进一步交流。
肿瘤新生抗原成为基于T细胞的肿瘤免疫治疗的理想靶点,具有广泛的治疗前景和临床应用价值。
a.在免疫治疗中最主要的应用即开发个性化的新生抗原疫苗,包括多肽疫苗、核酸(DNA/mRNA)疫苗和树突状细胞(DC)疫苗等;
b.新抗原的过继细胞疗法,如在TCR-T疗法中,可以对外周血T细胞的TCR进行基因改造,引导其识别某些新抗原,以提高靶向肿瘤细胞的特异性;
c.肿瘤新生抗原与其他疗法如免疫检查点抑制剂(如PD-1/PD-L1)联合使用,防止免疫逃逸,提高临床治疗疗效;
百蓁生物的DeepImmu平台为客户提供了从样品处理到新抗原质谱鉴定、筛选以及验证的一站式完整解决方案,Fig3所示。利用质谱检测的方法进行免疫肽组的解析,再结合特有的AI算法发现新抗原,并对免疫原性进行预测,为下游的细胞学靶点验证提供更精准的新抗原候选列表与免疫原性的验证,干湿结合加速新生抗原的发现。
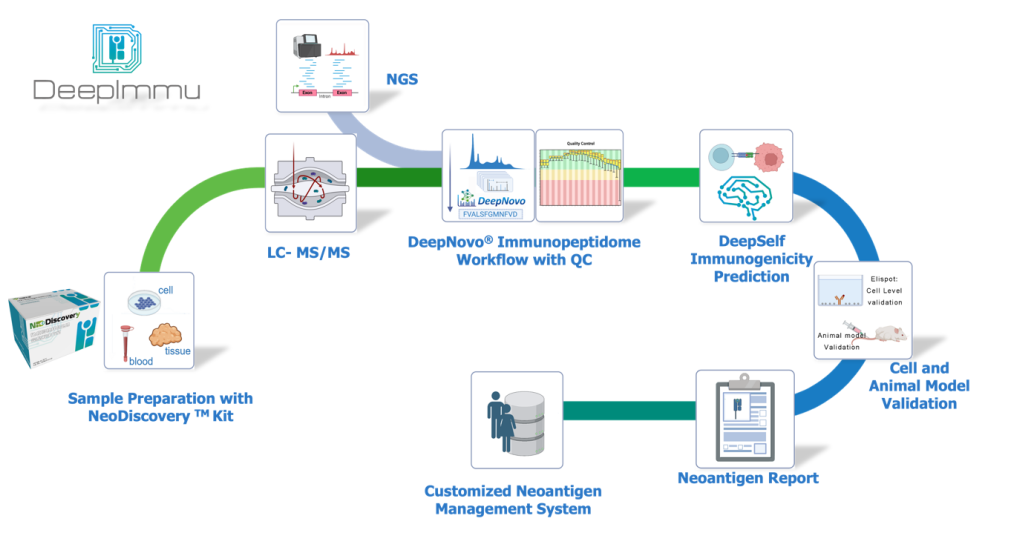
Fig3. 百蓁生物新生抗原发现的解决方案
整合DeepNovo数据分析和免疫原性预测新算法可实现四周“多.快.好.准”的从样本处理到新抗原验证的完整解决方案(含细胞水平验证),为后续免疫治疗研发提供强有力支持。
